京都府立医科大学
医学部医学科 化学教室
大学院医学研究科 医系化学
Graduate School of Medical Science, Kyoto Prefectural University of Medicine

研究内容
research
研究内容
1.ペプチドフォルダマーに関する研究
低分子医薬品、バイオ医薬品に次ぐ第三の医薬品として、中分子医薬品に注目が集まっています。ペプチドは、化学合成可能かつ化合物ライブラリー構築が容易なため、中分子医薬品の有望な素材です。しかしながら、試験管内で機能を示したとしても、生体内で十分な機能を発揮できるわけではありません。その理由として、生体内で安定な二次構造(コンフォメーション)をとることができないこと、豊富に存在する加水分解酵素により容易に分解されること、などがあげられます。私たちはこのような問題を解決するためのアプローチとして、非天然型アミノ酸を利用したペプチドフォルダマー研究に取り組んでいます。フォルダマーというのは、低分子を並べてオリゴマーにすると一定の二次構造をとる分子のことです。安定な二次構造をとることで生体内で十分な機能を示すことが可能になり、非天然型アミノ酸を利用することで加水分解酵素から認識されづらく機能が持続します。非天然型アミノ酸を独自に設計・合成し、ペプチド二次構造を自在に制御できる方法論を確立して、機能性ペプチドへの応用を目指しています。

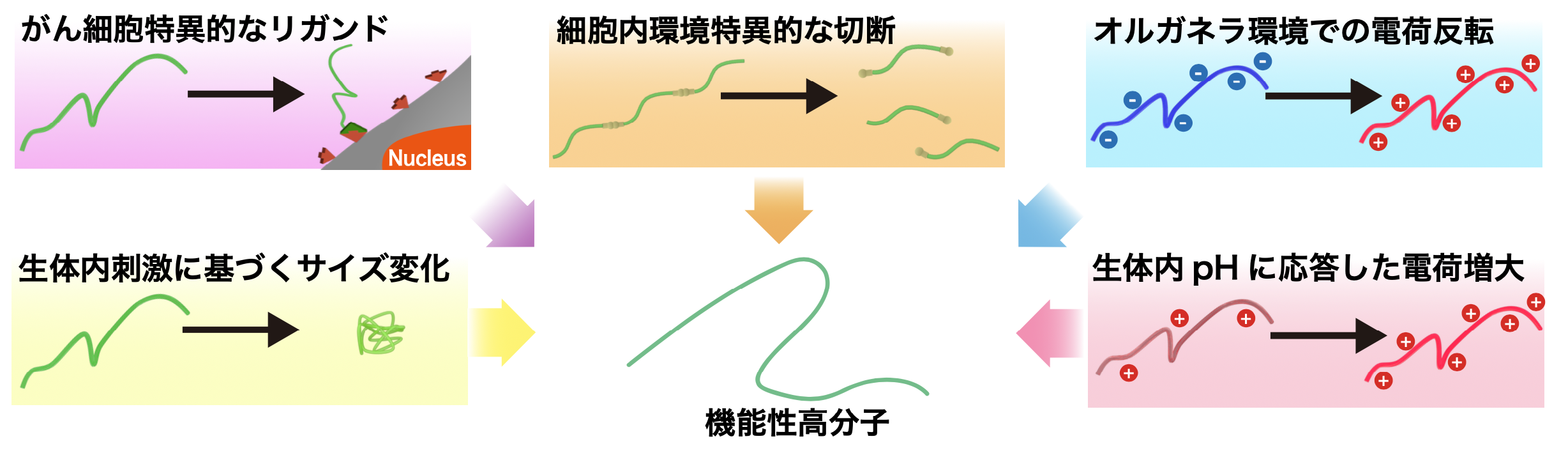
2.生体内微小環境に応答する機能性高分子の開発
生体内は各微小部位ごとに、異なるpHや酸化還元電位、酵素活性、代謝物の濃度等を有しています。薬剤にその環境の違いを巧妙に認識する分子設計(刺激応答性素子)を施すことで、微小部位(例えば疾患部位)特異的な機能発現(例えば薬効発現)を可能とします。 その刺激応答性素子の例として、リンカーの切断、電荷の変換と密度の変化、サイズの変化、特定の組織 (または細胞) への吸着などが挙げられます。これに関し、1つの分子に複数の刺激応答性素子を導入することが出来れば、異なる微小環境を次々に認識して機能を発現する高度な分子プログラムが実現されます。 高分子は単一分子内に多くの反応部位を持つため、組み合わせの制限なく複数の刺激応答性素子を導入出来、次世代型医薬に欠かせない素材だと考えられています。我々は、新しい高分子の設計・化学合成に始まり、物理化学的評価や種々の生物学的評価を通して革新的な創薬用高分子の構築へと挑んでいます。
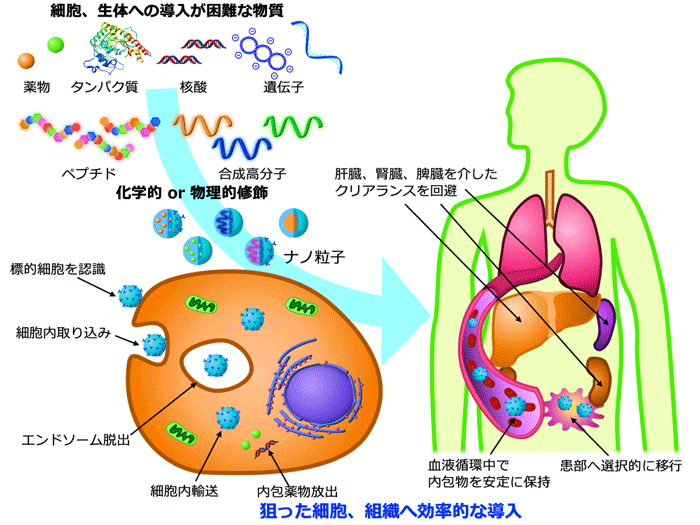
3.ドラッグデリバリーシステム開発
「必要なときに、必要な場所で、必要な量だけ薬物を作用させる」ことを目的としたドラッグデリバリーシステム(DDS)は、薬物の体内分布を量的・時間的・空間的に制御する方法論として発達してきました。特に近年、タンパク質・遺伝子・核酸を生体内の適切な場所に送り届け、細胞内へ高効率かつ低毒性で導入するDDSの開発に期待が寄せられています。私たちは、前述のペプチドフォルダマーや合成高分子を用い、薬物の動態を細胞、組織、生体レベルで精密に制御するためのDDS開発を行っています。遺伝子治療や核酸医薬の方法論として用いることで、現在の医療では困難な疾患の治療を目指すとともに、細胞生物学やケミカルバイオロジーの研究ツールへの展開も検討しています。
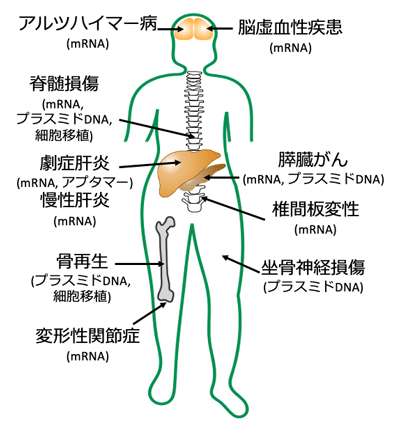
4.疾患治療への展開
「新技術を臨床開発、臨床応用へ展開する上で、小動物を用いた疾患治療試験が不可欠です。その過程で、レポーター試験等では得られないような情報が得られます。例えば、通常の毒性試験では検出されないレベルの軽微な毒性が、治療の過程に影響することもあります。治療研究の結果を踏まえ、臨床開発に進むこともあれば、その結果をフィードバックさせ基礎研究に戻る場合もあります。私たちは、プラスミドDNA医薬、mRNA医薬、siRNA医薬、核酸アプタマーといった核酸医薬を用いた治療や細胞移植治療において、全身の様々な疾患モデルの治療の経験があります。これらの経験を踏まえ、当研究室で生まれた新技術を用いた治療研究を行い、臨床開発へ展開します。